Un po' d'informazioni sulle batterie

- Cos'è una batteria?
- Da cosa è alimentata una batteria?
- La misura della corrente
- Quando fu creata la prima batteria?
- Com'è fatta una batteria
- Tipi di batterie e misuratori di carica
- Tipi di batterie ricaricabili
- Batteria al nichel-cadmio (Ni-Cd)
- L'effetto memoria
- Batteria al nichel-metallo idruro (Ni-MH)
- Batteria al nichel-metallo idruro a bassa autoscarica (Ni-MH Low Self Discharge)
- Batteria agli ioni di litio (Li-ion)
- Batteria ai polimeri di litio (Li-Poly)
- Batteria alcalina
- Per un uso corretto: sfatiamo i luoghi comuni sulle batterie
- Consigli utili
- Prenota il cambio batteria iPhone
Contattaci qui, e ti richiameremo noi!
Quest'articolo è stato aggiornato il giorno: martedì 4 febbraio, 2025
Vi sarà capitato, almeno una volta, di sentirvi fare questa domanda:
“Ma scusa, perché la batteria del mio telefono/smartphone/tablet dura così poco?”
È una domanda abbastanza retorica, a cui non è possibile dare una risposta, neppure una generica.
La durata di una data batteria è sempre relazionata alla sua capacità, e all’uso che di essa se ne fa. Detta molto, ma molto semplicemente.
Sebbene sia superfluo sottolineare che noi tutti si viva in un universo in cui vige la regola della relatività, la dimensione del tempo, parlando di uso di un dispositivo alimentato a pila, è veramente un concetto relativo. Nel senso non solo fisico, ma letterale, del termine.
Relativamente, quindi, bisognerebbe quindi rispondere: “Dipende dall’uso che ne fai”.
Sì, è una risposta veramente banale.
Ma, del resto, a domande banali, è difficile rispondere con risposte migliori.
Comunque sia, il problema principale non è tanto la banalità della domanda, e dell’ovvia banale risposta, ma l’inghippo che sta a monte.
Gran parte della gente ignora sia cosa sia effettivamente una batteria (ricaricabile o meno), sia come sia costruita, e sia come funzioni.
Questo articolo, per ovvi motivi, non vuole fornire un’accurata spiegazione fisica sul concetto di ‘carica elettrica’, e neppure ha la presunzione di darvi ragguagli di livello universitario sulla fisica dei conduttori, ma è solo una traccia.
Diciamo che è una guida scritta in maniera molto chiara e spicciola, che potrà esservi utile nell’intricato mondo degli accumulatori elettrici.
Affinché, magari, possiate usare la meglio i vostri dispositivi Apple che necessitano di una carica elettrica continua e portatile.
 ATTENZIONE
ATTENZIONE 
Il vostro iPhone non si accende più, e sembra definitivamente morto?
Anche attaccando il connettore di ricarica al relativo cavo collegato al caricabatterie, il telefono non da segni di vita?
Oppure si accende, però appena staccate il cavo si spegne improvvisamente?
Prima di buttarlo, aspettate!
Forse, è solamente la batteria che ha raggiunto la sua fine, ed è totalmente esausta!
Oppure, è il connettore di ricarica che, rotto, non permette più la carica dell'accumulatore!
Noi possiamo eseguire una rapida analisi del vostro iPhone in tutta Milano e, laddove possibile, ripristinarne il corretto funzionamento! E tutto, al più conveniente prezzo di mercato!
Prima di dichiarare la morte del vostro dispositivo, chiamateci al 333.29.22.308.
Possiamo eseguire un cambio rapido della batteria, o del connettore di ricarica, in soli 10 minuti!
Cos'è una batteria?
Scientificamente parlando, è un contenitore che stocca, in quantità e modalità variabile da tipo a tipo, un tot di elettroni potenzialmente utili a svolgere lavoro.
In parole molto più semplici: è un dispositivo che immagazzina, per una certa quantità di tempo, una certa quantità di energia.
L'energia, che non ha né forma e né sostanza ma permea tutto l'Universo, in questo caso ha la forma di elettroni potenzialmente utili.
Risulta comunque utile chiarire che per ‘potenzialmente utili’ dovete leggere ‘dotati di possibilità di movimento’.
E questo, per quanto banale e scontato per gli addetti ai lavori, non è sempre capito dalla gente comune: se hai una Ferrari con le gomme bucate, e che quindi è impossibilitata a muoversi, è abbastanza inutile. Bella, ma inutile.
Stessa cosa con gli elettroni: sono particelle dotate di carica elettrica e segno (negativo), molto veloci, che amano ruotare vorticosamente su se stesse (hanno quindi spin), a cui piace slegarsi molto facilmente dagli orbitali atomici esterni in cui risiedono e, nel contempo, amano respingersi a vicenda; e che adorano stare vicine-vicine ad altre particelle di carica elettrica opposta (tipo i protoni).
Per le loro caratteristiche, quindi, gli elettroni tenderanno sempre a muoversi da un punto in cui la loro presenza è massiccia, ad un altro punto dove invece ci sono le cosiddette ‘lacune’, ovvero porzioni di materia che presentano, per l’appunto, carenze elettroniche.
Su questo presupposto, si basano le interazioni chimiche tra gli elementi, che vengono sfruttate, tra le altre cose, proprio per costruire le batterie.
Da cosa è alimentata una batteria?
Una generica batteria è alimentata dall'energia chimica che imprigiona una definita differenza di potenziale, e che verrà sfruttata per obbligare gli elettroni a percorrere un dato circuito.
Il che, ci riporta all’interazione elettromagnetica. Ovvero: una delle quattro forze fondamentali che regolano tutto l'Universo.
Tale forza permette agli elettroni di percorrere un materiale conduttore, attirati sistematicamente delle zone ‘positive’ dove annidarsi.
È alla famosa Legge di Coulomb, ed è prerogativa essenziale della ‘corrente elettrica’ per come noi la conosciamo.
Infatti, proprio il termine corrente elettrica lascia ben intendere, il flusso elettronico che scorre in cavi, circuiti vari (anche nel nostro corpo) non è niente altro che un fiume elettronico in piena, che scorre da un senso ad un altro (si chiama polarità), con ondate più o meno ritmiche ed intense (frequenza ed intensità), e con una velocità più o meno elevata (tensione).
Maggiore sarà l’attrazione che il fiume di elettroni avrà per il suo ‘mare’ (una carica positiva, od una lacuna, in questo caso), maggiore sarà la tensione.
Maggiore sarà la quantità di elettroni che, nello stesso periodo, arriveranno 'alla foce', maggiore sarà l’intensità.
Più numerose saranno le ondate con cui lo faranno, maggiore sarà la frequenza.
La polarità degli elettroni, ovvero il loro senso di direzione durante la loro marcia inesorabile, può essere positiva, oppure negativa.
Attenzione a non confondere il concetto di carica elettrica con la polarità: la carica degli elettroni è SEMPRE di segno negativo, mentre la loro polarità, ovvero la loro direzione di movimento in un dato circuito, può avere parametri + o -.
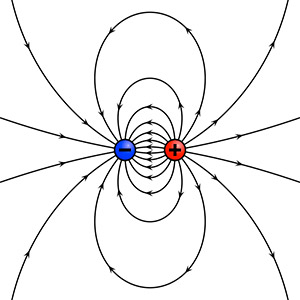
Lo schema del più semplice dipolo elettrico: le cariche elettriche negative generano un campo eguale ma di pulsazione inversa rispetto alle cariche positive
Così come un fiume, solitamente, è generato da un ghiacciaio (o comunque una riserva d’acqua generica), che lo alimenta, così un determinato dispositivo elettronico ha bisogno di essere alimentato da corrente elettrica.
Ora, per i dispositivi che si attaccano direttamente al circuito fisso della vostra casa (chiamasi impianto), non ci sono particolari problemi: il flusso elettronico è difatti garantito dalla vostra centrale elettrica cittadina che, in vari modi, immette costantemente una certa tensione elettrica, con una certa intensità ed a intervalli costanti, nel vostro impianto.
Il problema è che moltissimi dispositivi, ve li dovete portare in giro, e che non potete fisicamente collegarli alla presa del vostro muro.
La misura della corrente
Come qualsiasi altra cosa esistente nell’Universo, anche il flusso elettronico, pur se formato da particelle elementari di misura sub-atomica, può essere analizzato e misurato.
Purtroppo, è matematicamente impossibile (per il principio di indeterminazione di Heisenberg), sapere contemporaneamente la posizione di un elettrone e la sua velocità; però noi, in effetti, quando analizziamo un flusso elettronico, stiamo analizzando un corpo formato da tanti altri corpi, singoli è vero, ma che si muovono come se fossero un tutt’uno.
Un po’ come l’acqua (ed i liquidi in generale): effettivamente, nell’uso quotidiano poco ci importa cosa combinino le singole molecole di ossigeno ed idrogeno. Noi le trattiamo comunque come un corpo liquido unico, e ne regoliamo di conseguenza l’utilizzo.
Stessa cosa per il flusso elettronico.
Per misurare quindi il fiume di elettroni che passano in un dato circuito, si utilizzano le seguenti misure:
(Nota: non dovete impararvele tutte a memoria per vivere sereni ed usare al meglio le vostre batterie, ma una cognizione generale di cosa effettivamente potete misurare, parlando di elettricità, male non vi fa)

Il grande André-Marie Ampère, pioniere dell'elettMilanognetismo nella Francia... Illuminata, è il caso di dirlo :)
Intensità
È la misura fondamentale dell’elettricità, ed il suo indicatore è l’ampere ed il suo simbolo nel Sistema Internazionale (di cui è misura fondamentale) è la lettera A, in onore del grande fisico francese André-Marie Ampère, che fu trai primi a studiare nel dettaglio il campo dell’elettMilanognetismo.
In pratica, l’ampere misura l’intensità della corrente elettrica. Detta molto semplicemente, è la quantità di elettroni che effettivamente passano in un circuito in un dato momento.
È inutile sottolineare che un generico dispositivo elettronico può operare solo entro un certo intervallo dell’intensità, oltre il quale il circuito (progettato per reggere uno specifico amperaggio), fonde (letteralmente).
Datosi che l’amperaggio dei circuiti presenti nelle abitazioni è molto elevato (per svariati motivi) ed invece i caricabatterie necessitano di molta meno intensità, tutti incorporano un trasformatore, che riduce appunto sia la tensione che l’intensità, fornendo quindi un amperaggio in uscita molto più basso di quello in entrata.
Ancora, alcuni caricabatterie possono regolare l’amperaggio in uscita in automatico (quasi tutti), altri permettono una regolazione manuale;

Il grande Alessandro Volta, ritratto in vecchiaia, con accanto la sua invenzione più famosa (ed ancora usata): la pila voltaica
Tensione (o voltaggio)
È la differenza di potenziale elettrico, e la sua misura del Sistema Internazionale è il volt (V) in onore del grande scienziato italiano Alessandro Volta, pioniere dell’elettricità ed inventore, come già accennato, della prima pila elettrica (chiamata anche pila voltaica in sua memoria).
Concettualmente, non c'è differenza tra la prima pila costruita da Volta rispetto alle moderne pile agli ioni di litio che usiamo oggigiorno.
Tutte le batterie esistenti, così come tutti i dispositivi che esse alimentano, lavorano entro una certa soglia di voltaggio; in pratica, la tensione è paragonabile ad un elastico teso: più aumenta la tensione dell’elastico, più energia cinetica si accumula (e più aumenta la differenza di potenziale rispetto ad un elastico invece a rilascio).
È un altro modo per dire ‘quanto vanno veloci’ gli elettroni, detta in maniera ingloriosamente dilettantistica.
Al contrario di come erroneamente molti credono, la tensione con cui eventualmente si viene a contatto non è di particolare rilevanza per un organismo vivente, al contrario invece dell'intensità.
Per vari motivi di convenienza energetica, il voltaggio mandato industrialmente alle civili abitazioni ed alle industrie parte dalla centrale in alta tensione, e poi viene abbassato (grazie all'uso di pratici trasformatori) prima di essere immesso nei circuiti privati. La tensione inviata cambia da Paese a Paese: in Italia, come in buona parte d’Europa la Corrente Alternata viene inviata nelle case a 230V, mentre negli USA e nel nordamerica in generale, ad esempio, si usano i 110V.
Questo, in passato, era un grosso ostacolo al commercio globale di apparecchi elettrici/elettronici.
Il problema si è risolto negli ultimi 20 anni circa: ormai praticamente tutti i caricabatterie e gli alimentatori moderni, sono multi-tensione (in genere, lavorano dai 100V ai 240V) e pertanto potete usarli in pressoché tutto il mondo;

Il grande Heinrich Rudolph Hertz, inventore del primo dipolo elettrico (chiamato hertziano in suo onore)
Hertz
È la misura della frequenza di un certo evento al secondo, ed il suo simbolo nel Sistema Internazionale è Hz. Prende il nome dal grande fisico tedesco Heinrich Rudolph Hertz, che per primo dimostrò come le onde elettMilanognetiche non solo esistevano, ma che potevano anche essere prodotte per mezzo di un’antenna, a partire da un flusso elettronico (il famoso dipolo hertziano).
L’Hz è usato in moltissimi contesti, non solo in elettronica, e serve a misurare sempre frequenze di eventi generici; nel caso della corrente elettrica, misura la frequenza dell’alternata che viene mandata, industrialmente, nelle nostre case e nelle nostre fabbriche. Generalmente, in quasi tutto il mondo la corrente alternata cambia la propria polarità 50-60 volte al secondo: 50-60Hz, quindi.
Se sul vostro caricabatterie c’è scritto 'input AC 50-60Hz', ed è multi-tensione, potete star sicuri che funzionerà in praticamente tutto il globo;

Il grande George Simon Alfred Ohm. La sua famosa legge, è di fondamentale importanza per lo sviluppo di tutta la scienza dei conduttori elettrici
Resistenza
È la misura che, come lascia intuire il nome, vi dice quanto un generico materiale (o parte di un circuito) ‘resiste’ al passaggio degli elettroni.
Ovvero: fa da scudo, bloccandone totalmente (o parzialmente) il flusso.
La sua unità di misura è l’ohm, ed il simbolo del Sistema Internazionale è quello dell’omega greco (Ω), in onore al grande matematico tedesco Georg Simon Alfred Ohm che, continuando gli studi di Alessandro Volta, si rese conto che c’è una proporzionalità ben precisa tra la differenza di potenziale elettrico ai capi di un conduttore (voltaggio o tensione) e l’intensità del flusso elettronico che lo attraversa (amperaggio). Questa costante di proporzionalità, nota come legge di Ohm, è la resistenza elettrica.
Va da sé che più un materiale è resistente alla corrente elettrica (quindi, in gergo, ‘oppone resistenza’ al flusso elettronico), più deve essere potente ed intenso il flusso elettronico, per superare tale resistenza.
L'unità di misura inversamente proporzionale all'ohm è invece il Siemens, che misura la conduttanza.
Il concetto di resistenza è fondamentale nell’elettronica e nella computazione in generale, datosi che le porte logiche di qualsiasi CPU, sono costruite appositamente per far passare o meno il flusso elettronico (grazie ai semiconduttori, come il silicio);

Il grande James Watt ideatore, tra le tante cose di cui si è occupato, del primo esempio di motore a stantuffo e volano
Potenza
È la misura della capacità di lavoro dell’energia, rapportata in una data quantità di tempo.
La sua unità di misura, del Sistema Internazionale, è il watt (W), in onore del grande ingegnere meccanico scozzese James Watt, famosissimo per molte cose, ma principalmente per i suoi studi sul vapore e le sue invenzioni meccaniche ad esso correlate.
Se tutt’ora le nostre autovetture camminano, è perché Watt ideò per primo il sistema meccanico che trasforma il moto rettilineo alternativo di un pistone nel moto rotatorio continuo del volano.
Nell’elettronica, il watt è esattamente 1V · A. Importantissima, per gli usi comuni di tutti noi, è l’unità di misura dal watt derivata, ovvero il wattora che misura la potenza per il tempo di un'ora.
Quasi tutti gli impianti elettrici di uso civile residenziale hanno un impianto che regge un massimale di wattora, usualmente moltiplicati per 100 (kilowattora) e, semmai la potenza totale assorbita dall’impianto risultasse superiore alla sua capacità massima, scatterebbe sempre in automatico il limitatore di sicurezza (il famoso magneto-termico), obbligatorio per legge, che aprirebbe il circuito immediatamente, impedendo così incendi e pericolosi danni a cose e persone.
Ogni elettrodomestico o dispositivo elettronico, consuma una certa quantità di watt, che è molto bassa in alcuni casi (TV, computer, ad esempio) ed altissima in altri (scaldabagni elettrici, stufe elettriche, asciugacapelli, elettrodomestici pesanti in genere);

Il simbolo internazionale della Corrente Alternata
AC
Acronimo dall’inglese alternating current (corrente alternata in italiano).
È una particolare modalità di trasmissione del flusso elettronico, usata in tutto il mondo per fornire energia dalle centrali elettriche alle utenze finali, in cui polarità ed intensità del flusso elettronico si scambiano periodicamente nel tempo con una certa frequenza.
In pratica: ogni tot di tempo (misurato in Hz), le pulsazioni negative si alternano alle pulsazioni positive; vale a dire che il flusso elettronico cambia di verso nel vostro circuito di casa, continuamente ed entro certi intervalli temporali.
È il motivo per cui i vostri connettori a muro (in gergo, spine elettriche) non hanno inserti positivi e negativi, e possono essere quindi connessi con la presa in qualsiasi verso (si dice 'non sono polarizzati', in gergo).
Datosi che quasi tutti i dispositivi elettronici necessitano invece di corrente continua per funzionare, qualsiasi alimentazione per essi (che non sia a batteria) prevede l’uso di un raddrizzatore;

Il grande Nikola Tesla, che ideò e riuscì ad imporre la trasmissione di corrente AC come standard mondiale
Datosi che i giganteschi alternatori delle centrali elettriche producono spontaneamente corrente alternata, e che questa può essere inviata in alta tensione per moltissimi chilometri perdendo poca o nulla energia, è conveniente indutrialmente usare questa modalità di trasmissione.
Grazie all'uso di semplici trasformatori, la tensione poi può essere abbassata prima di immetterla negli impianti privati.
Tutto questo fu progettato, e brevettato, dal grande fisico ed inventore serbo Nikola Tesla, nei primi decenni del 1900.

Il simbolo internazionale della Corrente Continua
DC
Acronimo dall’inglese direct current, ovvero corrente continua in italiano. È la sola trasmissione del flusso elettronico che possono dare le batterie, in cui la polarità e l’intensità della corrente di elettroni rimane sempre costante nel tempo.
Tale corrente è prodotta anche da un generatore dinamo e, almeno fino all'invezione degli alternatori, fu l'unica modalità di trasmissione del flusso elettronico possibile.
In pratica: gli elettroni percorrono sempre lo stesso verso nel circuito, sempre alla stessa intensità e non scambiano mai le loro pulsazioni.
Questo è il motivo per cui tutte le batterie DEVONO essere inserite nel dispositivo rispettando SEMPRE la polarità.
Il vostro caricabatterie di fiducia, altri non è che un trasformatore/raddrizzatore, in buona sostanza: prende corrente alternata dal vostro circuito di casa a (diciamo) 16A e 230V, e la trasforma in corrente continua a, diciamo sempre, 1A e 4V.
Quando fu creata la prima batteria?
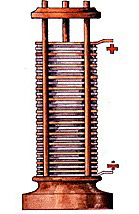
La prima pila elettrica del mondo, costruita da Alessandro Volta
Studiando gli allora ben poco conosciuti elettroni e le loro pazze interazioni, molti ma molti anni fa, verso la fine del 1700, un geniale scienziato italiano chiamato Alessandro Volta costruì la prima pila elettrica.
Lui effettivamente ancora non lo sapeva, ma il suo lavoro stava aprendo la strada a (forse) la più importante delle evoluzioni scientifiche umane: l’uso controllato della corrente elettrica.
Per farlo, seguì e migliorò gli studi di un altro geniale scienziato italiano, Luigi Galvani, ed assemblò la prima pila accumulatrice in maniera forse empirica, ma comunque efficace.
Per creare differenza di potenziale, usò un semplice supporto di legno, con base circolare, e dei dischetti di rame e bronzo messi uno impilato sull’altro (da cui il nome pila, per l’appunto), alternati tra di loro con un panno imbevuto di una soluzione acida di acqua e acido solforico.
Due fili di rame posti agli estremi della pila, poi, completavano l’opera.
Tale rudimentale, seppur perfettamente funzionante, prima batteria, produceva un flusso elettronico con tensione sufficiente a compiere lavoro, e Volta divenne infatti molto famoso per le sue dimostrazioni pubbliche che impressionavano di molto gli spettatori (tra di essi, ci fu anche Napoleone Bonaparte).
Quando Volta costruì la prima batteria, per la prima volta nella storia di questo pianeta, un essere umano era riuscito ad ‘imbrigliare’ l’energia del già citato ‘fiume elettronico’, e la poteva usare per produrre lavoro.
Era la fine del del XVIII secolo circa, e la prima pila elettrica era stata inventata.
In onore del grande inventore italiano, ancora oggi la batteria primaria viene chiamata anche ‘pila voltaica’, mentre la misura della tensione della corrente elettrica, come abbiamo visto prima, è chiamata informalmente voltaggio, e la sua corrispondente unità di misura del Sistema Internazionale è il già citato volt.
Com'è fatta una batteria?

Essenzialmente, qualsiasi batteria (chiamata anche generatore elettrico) è un dispositivo che converte la differenza di potenziale chimica di due elementi (o leghe, o misto lega-elemento, la scelta è molto ampia) in un flusso elettronico, e che quindi fornisce una certa quantità di energia elettrica per un certo carico di lavoro in un certo periodo di tempo.
Dalla prima rudimentale pila di Volta di rame e zinco, ormai siamo arrivati a costruire svariati tipi di batterie, ma il concetto di base è sempre quello: c’è sempre bisogno di almeno due elementi, interposti tra di loro da un conduttore/moderatore, che si scambino elettroni.
O meglio, per essere più precisi: c’è bisogno che da un elemento contenente una data differenza di potenziale, si passi elettroni ad un altro elemento, contenente una differenza di potenziale più bassa.
Un po’ come una cascata, per intenderci: l’acqua che sta su ha molta più energia potenziale di quella che sta giù. E, difatti… Cade. Sembra banale, ma è proprio così.
Continuando i parallelismi, c'è da dire che l'acqua che sta per cadere da una cascata, ha molta energia potenziale perché esistela forza di gravità, che ne attirerà inesorabilmente la massa.
Stessa cosa per la differenza di potenziale degli elettroni, ma stavolta la forza mediatrice è quella elettromagnetica.
A prescindere dai materiali utilizzati, quindi, ogni batteria necessita obbligatoriamente di almeno:
- Un elemento a potenziale elettrico più elevato, chiamato anodo. Convenzionalmente, nelle pile voltaiche, datosi che l’anodo è l’elemento che fa partire la reazione chimica (e che quindi, comincia a ‘trasmettere’ gli elettroni al catodo, che li riceve) il suo segno è positivo, quindi +;
- Un elemento a potenziale elettrico più basso, chiamato catodo. Anche qui, convenzionalmente e nelle pile voltaiche, datosi che il catodo è l’elemento che invece accetta gli elettroni dall’anodo, il suo segno è negativo, quindi - ;
- Un elemento tra i due elementi, con il duplice compiuto di impedire il passaggio involontario degli elettroni (a circuito aperto), ed invece agevolarlo quando è necessario (circuito chiuso). È l'elettrolita;
- Ovviamente, due contatti elettrici in prossimità di anodo e catodo, conduttivi, per chiudere il circuito che la batteria dovrà alimentare.
Oggigiorno, abbiamo decine di modelli di batteria con tantissimi elementi costituenti e dalle più svariate applicazioni, ma il concetto è comunque sempre quello: si immagazzinano, chimicamente, certe quantità di elettroni in un punto ad alta differenza di potenziale, e poi si fanno passare verso un altro punto, a differenza di potenziale più bassa.
Il passaggio elettronico ed il suo flusso, quindi, sono usati dal circuito elettrico a cui la batteria è connessa, per compiere lavoro.
Semplice.
Tipi di batterie e misuratori di carica

Cominciamo col dire che le batterie in primis si dividono in due grandi gruppi fondamentali:
- Batterie non ricaricabili;
- Batterie ricaricabili
Le batterie non ricaricabili sono chiamate batterie primarie (o generatori primari) e, come dice il nome stesso, non possono essere ricaricate di elettroni.
Ovvero: quando il processo di passaggio tra i due elementi conduttori è concluso (ossidazione completa), la batteria diventa inservibile e deve essere smaltita.
Quindi, il processo di ossidazione del catodo è irreversibile.
Tali batterie sono comunemente chiamate ‘usa e getta’, e se ne trovano di tutti i tipi in commercio: AAA, AA, C, D, da 9V… Tantissimi tipi per pressoché infiniti dispositivi ed usi.
Le batterie ricaricabili, invece, sono pile che possono essere ricaricate, come giustamente suggerisce il nome.
Sono quelle che ci interessano di più, perché i nostri fiammanti MacBook Pro, i nostri iPad, iPhone ed iPod le usano intensivamente.Sono chiamate più propriamente accumulatori elettrici, oppure batterie secondarie, per distinguerle appunto da quelle primarie, che sono quelle non ricaricabili.
Negli accumulatori, quindi, il processo di ossidazione del catodo è reversibile e, rifornendo la pila di adeguato flusso elettronico, essa può ricominciare il processo (si chiama ciclo) di ossidazione.
Di batterie ricaricabili ne esistono di tanti, tantissimi tipi, per moltissimi usi e per pressoché tutti i dispositivi che necessitano di un apporto elettronico.
Quando si deve acquistare, o sostituire, una batteria, generalmente è bene sempre controllarne prima i parametri, che debbono essere compatibili con il dispositivo che la batteria dovrà alimentare.
Tali parametri sono pochi, semplici, ma ve li dovete imparare a memoria.
Essi sono:
- Tensione (o voltaggio)
Ne abbiamo parlato prima in alto, ed quivale alla differenza di potenziale elettrico; - Capacità
In breve, è quanti elettroni può immagazzinare la vostra batteria.
Oppure, per essere più precisi: quanti elettroni rispetto ad una data quantità di tempo, la stessa batteria può erogare.
La misura per quantificare la quantità quindi (si perdoni il gioco di parole) è un rapporto temporale.
E, considerato che, come abbiamo già visto, in pratica la quantità di elettroni è l’intensità, useremo quindi l’ampere (A) rapportato al tempo, diciamo un’ora (h).
Datosi che 1A è un'unità molto grande, si usa comunemente un suo sotto-multiplo, ovvero il milliampere (mA), che è pari ad 1/1000 di ampere.
Un milliampere per ora quindi (1mAh), equivale ad 1 milliampere erogato per 3600 secondi.
Ne consegue che: più aumentano i milliampere per ora, più la batteria è capiente.
Attenzione: non ‘dura di più’, ma 'più capiente'.
Il confetto di ‘durata’, come già detto più volte, è relativo all’uso che ne fate. - Dimensioni e connettori
Datosi che esistono un numero pressoché infinito di dispositivi che necessitano di un accumulatore elettrico, sono stati prodotte un numero altrettanto infinito di pile, dalle dimensioni e dai connettori più disparati. Alcuni, sono connettori standard, condivisi da moltissimi dispositivi; altri, sono connettori con attacco proprietario, e possono essere utilizzati solo da una particolare batteria, con una particolare forma e per un particolare dispositivo.
Solitamente (ma è una traccia generale, non prendetela come oro colato), per dispositivi generici, di largo o larghissimo consumo, i produttori tendono ad adattare connettori e forme standard, mentre per altri dispositivi, tipo cellulari, tablet, laptop e smartphone, che necessitano di batterie particolarmente sottili, leggere (quando possibile) e performanti, i produttori progettano e costruiscono batterie specifiche, non intercambiabili con altri modelli.
Per le batterie di largo e generico uso, le dimensioni standard più comuni sono: AA, AAA, C, D, 9V.
Il voltaggio è solitamente disponibile da 1,5V a 9V, a seconda del produttore e del modello funzionale.
Le batterie AA sono in gergo chiamate ‘stilo’, per la tipica forma a cilindretto (diametro dai 13,5 ai 14,5mm) , mentre le AAA son chiamate ‘mini stilo’, poiché sono più piccole (diametro 10,5mm), sebbene mantengano la solita forma stilo.
Le batterie C sono chiamate in gergo ‘mezza torcia’, e sono in pratica delle stile con un diametro molto più corposo (26,2mm).
Le batterie D, chiamate ‘torcia’, sono ancora più grandi, ed hanno un diametro di 34,2mm.
Queste, quelle a cilindro.
Estremamente popolari, hanno prezzi modici: si può comperare un pacco di AA o AAA ricaricabili di ottima marca e ottima capacità (oltre i 2000 mAh) per circa 10 Euro.
Esistono poi quelle rettangolari, che vanno dai 6 ai 9V di tensione.
Tra di esse, è molto famosa e popolare la 9V, dai tipici connettori maschio-femmina posizionati parallelamente, sulla sommità della batteria.
Parlando di dimensioni delle batterie, vale la pena ricordare gli accumulatori a bottone, ovvero mini-batterie dalla classica forma di moneta (o bottone, per l’appunto), molto sottili e dal diametro molto minuto, che sono perfette per alimentare orologi al quarzo da polso, oppure gli stessi orologi interni (sempre al quarzo) dei calcolatori.
Ne esistono di vari diametri, e la tensione è di 3V (a circuito chiuso), mentre a circuito aperto vanno a 3,6V.
Alcune di esse, usate da produttori mondiali di orologi, hanno dei cicli di vita lunghissimi: nei sistemi Eco-Drive della Citizen, ad esempio, gli alimentatori vengono ricaricati da un microscopico pannello solare e hanno una durata media di circa 10 anni… Tantissimo, per una batteria ricaricabile!
Tipi di batterie ricaricabili
Per facilitarvi la vita nel marasma di sigle, numeri e compagnia bella, eccovi una sintetica descrizione degli accumulatori più usati, specie in ambito elettronico; che poi è quello che, si presume, vi interessa di più.
Prego, notate che questa non è e non vuole essere una lista completa, ci mancherebbe; anche perché sarebbe abbastanza lunga e difficile da fare. Non sarebbe poi così utile, visto che sono disponibili già liste completissime su molte altre parti.
Batteria al nichel-cadmio (Ni-Cd)

Accumulatore molto antico, uno dei primi ad essere prodotto su larghissima scala, oggigiorno rimpiazzato quasi totalmente dal nichel-metallo idruro.
Estremamente economica nella produzione, ha una vita decisamente lunga, circa 1500 cicli, e si ricarica abbastanza velocemente.
I difetti, che ne hanno decretato la fine della produzione su larga scala a vantaggio delle NiMH, sono una tossicità spaventosa (i metalli costituenti sono pesanti, quindi estremamente tossici per l’essere umano, quando non smaltiti a dovere) e il problematico difetto del famoso ‘effetto memoria’; oltreché, un’auto-scarica considerevole.
A questo punto però, prima di procedere con la lista dei tipi di batterie, è necessario specificare cos’è l’effetto memoria, che tanto ci ha assillato, almeno fino ai primi anni ’90.
L'effetto memoria
Le batterie ricaricabili Ni-Cd, così anche come (sebbene in misura inferiore) le Ni-MH, hanno un bruttissimo difetto congenito: se ricaricate prima della loro scarica completa, sembra come se si ‘ricordino’ il punto in cui le si ha caricate. Direte voi: ‘OK, che problema c’è?’.
Il problema è che se si ricarica una batteria, diciamo mentre è ancora piena al 60%, l’accumulatore si ‘ricorderà’ tale percentuale di carica e anche se la ricarichiamo, non riusciremo mai ad effettuare una ricarica del 100% pieno… Perché quel 40% che mancava alla batteria per ricaricarsi completamente, verrà sistematicamente ignorato.
È un gran bel problema!
Ma perché avviene ciò?
In sintesi, senza riempirvi la testa di fisica nucleare: perché i cristalli di cadmio che costituiscono uno dei due elementi principali della batteria, aumentano di dimensione, in proporzione al loro livello di ossidazione. È detta molto semplice, e forse anche non tecnicamente corretta, ma così succede.
A volte i cristalli, che hanno già di per sé stessi la peculiarità di aggregarsi spontaneamente, crescono e si aggregano così tanto che rompono il separatore tra catodo-anodo e cortocircuitano la batteria.
Questo è raro, va detto, ma può succedere.
Molto più frequentemente, comunque, i cristalli crescono fino ad un certo punto, che corrisponde, guarda caso, al livello di ossidazione del catodo: ovvero, la percentuale di scarica della batteria. I cristalli rimangono quindi così, di dimensioni non regolari, anche quando si tenta di ricaricare l’accumulatore… Che quindi non riuscirà a riempire di nuovo tutte le celle al 100%.
Questo è davvero un bel problema perché, alla lunga, la percentuale di cristalli cresciuta di dimensione abnorme diverrà talmente alta che renderà l’utilizzo della batteria impossibile.
Per ovviare a questa sciagura, c’è poco da fare: serve scaricare completamente la batteria, e solo poi ricaricarla.
Infatti molti caricatori delle Ni-Cd e delle Ni-MH, hanno anche l’opzione ‘scaricatore’, che sarebbe sempre bene utilizzare prima di eseguire una nuova carica.
Il difetto dell’effetto memoria è stato uno dei motivi per cui, gradualmente, le batterie Ni-Cd (e, in differente misura, le Ni-MH) sono state abbandonate come accumulatori dei telefoni, smarphone e laptop, a favore delle ioni di litio e derivate.
Sarebbe infine da sottolineare come, nelle Ni-MH, al contrario delle Ni-Cd, l'effetto memoria sia reversibile: bastano un paio di cicli di carica-scarica completi (molti caricabatterie moderni, hanno un'apposita funzione che permette questo).
Batteria al nichel-metallo idruro (Ni-MH)

Evoluzione, se così si può chiamare, della batteria al Ni-Cd.
Al posto del cadmio, usano una particolare lega metallica che assorbe idrogeno (da cui il nome ‘metallo idruro’).
Tale batteria è estremamente più efficiente di quella Ni-Cd e, sebbene sia ancora presente, anche l’effetto memoria è molto più contenuto.
La mancanza del pesante cadmio la rende anche meno tossica e di più facile smaltimento.
Tra i problemi che presenta, oltre al già citato (leggero) effetto memoria, c’è sempre l’auto-scarica, anche se contenuta nei nuovi tipi LSD.
Ancora estremamente popolare ed economicamente accessibile a tutti, è usatissima per dispositivi di generico utilizzo.
Fino all’avvento delle moderne pile agli ioni di litio, le Ni-MH erano intensivamente usate nella telefonia mobile, spesso sotto forma dei famosi ‘pacchi batteria’; ovvero diverse pile Ni-MH AA oppure AAA unite assieme a formare un blocco unico.
Tale pacco batteria, di dimensioni spesso ben più che generose, era il principale responsabile delle gigantesche forme dei primi telefoni cellulari, sul finire degli anni ’80-inizio anni ’90: ve li ricordate?
Delle bestiole paurose, praticamente citofoni.
Batteria al nichel-metallo idruro a bassa autoscarica (Ni-MH Low Self Discharge)
Miglioramento significativo delle Ni-MH, l’autoscarica è così ridotta che molti produttori le mettono in commercio già belle cariche, cosicché il consumatore possa utilizzare immediatamente, per poi ricaricarsele da solo a ciclo esaurito. Si calcola che dopo ben sei mesi di inutilizzo, tali batterie conservino ancora oltre il 90% della carica iniziale: incredibile, per una Ni-MH!
Anche la loro potenza, è di svariate lunghezze superiore alle alcaline, rendendole utilissime per apparecchiature molto golose di energia (come ad esempio, foto e video-camere).
Batteria agli ioni di litio (Li-ion)

Gli accumulatori più diffusi in elettronica, soprattutto nella telefonia mobile, la cui ideazione e produzione ha permesso l’evoluzione dei dispositivi portatili che ora tutti noi usiamo.
Senza l’avvento delle potenti batterie Li-ion, molto probabilmente le incredibili performance dei nostri iPhone, iPad, iPod e Samsung Galaxy (tanto per dirne alcuni), così come dei nostri laptop di pressoché ogni marca, non sarebbero state possibili. E neppure ipotizzabili.
Tecnicamente, sono batterie in cui l’anodo è un sottilissimo strato di grafite, che viene opportunamente drogato con atomi di litio. Il catodo è invece un sale di litio, mentre l’elettrolita che funge da separatore è un solvente organico, sempre a base di litio.
I vantaggi di questo metodo di costruzione sono enormi: la batteria è potentissima, in base alla dimensione. Si pensi che solo sette grammi di litio, possono immagazzinare fino ad una mole di elettroni.
Per intenderci: una mole, corrisponde al famoso numero di Avogadro… A voi quindi i conti.
L’elevatissima densità delle batterie Li-ion permette capienze impensabili per le batterie Ni-Cd e Ni-MH.
E questo è estremamente importante nella telefonia mobile e nell’informatica in generale, dove display LCD e LED, antenne GSM, Wi-Fi e Bluetooth, altoparlanti e microfoni vari, richiedono considerevoli quantità di energia, per funzionare.
Tra le altre caratteristiche delle batterie agli ioni di litio, troviamo una durata di vita molto elevata, che male non fa mai.
Da sottolineare senza remore è l’assenza totale di effetto memoria, e la possibilità di caricare le batterie sempre, con qualsiasi percentuale di carica residua; anzi, più spesso si caricano, e più durano.
Dei difetti, solo tre, ma purtroppo molto pesanti: è una batteria estremamente costosa, se paragonata alle Ni-Cd e Ni-MH (anche se i prezzi sono crollati, negli ultimi 15 anni) e, soprattutto… Il solvente organico che fa da elettrolita diventa instabile, se la tensione scende sono una certa soglia. E può esplodere.
Purtroppo, sebbene sia un evento veramente raro, può succedere.
Per ovviare a tale, gravissimo pericolo, tutte le Li-ion hanno un controller interno che fa cessare immediatamente il flusso elettronico se la batteria scende oltre una certa soglia di tensione.
È uno dei motivi per cui, in quasi tutti i Sistemi Operativi (o firmware) moderni, il Sistema stesso vi avverte svariate volte dell’imminente shutdown, e la batteria non arriva MAI a zero, ma il tutto si spegne all’improvviso anche quando la percentuale è ancora di 5-8% circa.
Terzo ed ultimo svantaggio di tali batterie, è un degrado lento e progressivo che parte sin dalla fine della loro produzione: anche se non utilizzate, le celle agli ioni della batteria perdono la loro capacità originaria, costantemente. Si calcola che, mediamente, in un anno vita tali batterie perdano circa il 20% della capacità di carica totale. Tale degrado aumenta rapidamente se la batteria rimane inutilizzata per lunghi periodi.
Questo inconveniente rende tali accumulatori beni deperibili, e come tali gli ordinativi, nei centri ricambi ed assistenza, dovrebbero essere fatti calcolando bene la domanda totale della clientela, per evitare periodi di giacenza troppo prolungati.
Per concludere, è bene ricordare che l’auto-scarica è presente, anche se trascurabile (in media, meno del 5% al mese).
Batteria ai polimeri di litio (Li-Poly)

Evoluzione della precedente batteria agli ioni di litio, ne aumenta ancora di più la densità (è, a parimenti di volume, del 20% circa più densa) e, soprattutto, elimina la necessita del contenitore esterno in metallo per le celle di carica.
I sali di litio sono mischiati a delle sottilissime lamine polimeriche, così come lo stesso elettrolita. Il grande vantaggio quindi è che queste batterie, avendo sia anodo, catodo che elettrolito solidi, sottilissimi e molto malleabili, possono assumere pressoché qualsiasi dimensione.
Tutto ciò è manna dal cielo per i costruttori, che così possono forgiare le batterie in (virtualmente) qualsiasi dimensione, ed adattarle a qualsiasi esigenza progettuale; una caratteristica, questa, che ha permesso ai nostri più recenti smartphone di divenire così sottili e leggeri, nonostante le considerevoli quantità di corrente assorbita dai luminosi display LCD e dalle innumerevoli connessioni radio (quasi sempre attive).
Ancora, tra i vantaggi, l’elettrolita solido impedisce, in caso di rottura accidentale della batteria, la fuoriuscita dello stesso, che creerebbe gravi danni al dispositivo alimentato.
Gli svantaggi di queste batterie sono ancora una volta il costo elevato, la sempre presente infiammabilità dell’elettrolita e dei cicli di ricarica inferiori alle ioni di litio.
La pericolosità dell’elettrolita, che può provocare incendi ed esplosioni, è tenuta sotto controllo sempre da un controller specifico.
Il problema principale è che, se cortocircuitata, la batteria può esplodere: questo perché le lamine di polimeri di catodo ed anodo, sottilissime, offrono una resistenza bassissima al passaggio degli elettroni, che invece creano un fortissimo vortice elettronico, con un altrettanto fortissimo flusso di impulsi elettrici.
In realtà, i modelli attuali di queste batterie, non sono al 100% formate da polimeri puri, solidi, ma sono un ibrido.
L'elettrolita, difatti, è un conduttore gelatinoso organico, in cui sono immesse le lamine delle celle, e poi il tutto viene solidificato e sagomato a seconda delle necessità del produttore.
Le vere batterie ai polimeri di litio, con elettrolita in lamina solida, sono ancora in fase di test: non possono ancora essere commercializzate, perché sono instabili a temperatura ambiente, e funzionano bene solo ad alte temperature. Molto probabilmente, quando gli ingegneri che le sperimentano riusciranno a risolvere il problema della temperatura, assisteremo ad un nuovo paradigma per le batterie ricaricabili, visto che le polimeri di litio 'pure', promettono performance doppie rispetto a quelle attualmente in commercio.
Tra i modelli di smartphone e tablet più popolari che incorporano queste batterie, troviamo il nostro iPhone (dalla versione 4 in poi), il Samsung Galaxy, l’iPad (dalla seconda versione in poi).
Curioso è notare come la tecnologia a polimeri di litio, fosse di origine sovietica, e tenuta sotto strettissimo segreto militare fino alla caduta del muro di Berlino; dopo la quale, la smantellata macchina bellica sovietica decise di lucrarci sopra, rendendola disponibile commercialmente. Ed è stata un grande successo, possiamo dirlo col senno di poi.
Batteria alcalina

Batteria che è diventata quasi lo standard, per certi tipi di applicazioni.
Ha ottima potenza e, soprattutto, un’auto-scarica irrisoria: dopo una carica, si può infatti conservare per molti anni, praticamente intatta.
Non tutti sanno che le batterie primarie alcaline, sebbene considerate usa e getta, possono invece essere ricaricate, anche se per un numero abbastanza limitato di volte (circa una decina di cicli completi).
La condizione essenziale per farlo, però, è che la tensione totale delle celle della batteria non scenda mai sotto 1,25V.
Per ricaricarle, è necessario avere un caricabatterie apposito (non vanno bene quelli comuni solo per le Ni-Cd e le Ni-MH), e bisognerebbe anche prestare attenzione a ricaricarle spesso (carica parziale), proprio per evitare che la tensione scenda sotto i 1,25V, che renderebbero la batteria inservibile.
Negli ultimi anni, comunque, sono state immesse in commercio anche batterie alcaline appositamente progettate per essere ricaricate, anche se non hanno mai goduto di molta popolarità rispetto alle Ni-MH.
Per un uso corretto: sfatiamo i luoghi comuni sulle batterie
Purtroppo, come molte altre cose nella vita, l’ignoranza fa brutti scherzi. Anche in elettronica. Anzi: specialmente in elettronica!
Impossibilitata a capire la differenza tra 6V e 12V, oppure sapere esattamente di quanti circuiti dispone il proprio impianto di casa, la gente fa da sempre estrema confusione anche con le batterie.
Nel corso degli anni, si sono create vere e proprie leggende metropolitane, purtroppo perpetuate spesso e volentieri anche dagli ‘addetti ai lavori’ (commessi di elettronica, riparatori… Ed anche qualche ingegnere!) che, anche se l’Internet ora come ora mette a disposizione pressoché qualsiasi tipo di informazione, ancora sono durissime a morire.
Andiamo ad analizzarle, quindi. Ricordandoci che il ‘sentito dire’, oppure il ‘mi pareva giusto’… Non funzionano, con l’elettronica.
LUOGO COMUNE NUMERO 1
“La prima ricarica deve durare almeno 8 ore. Meglio se la si lascia in carica tutta la notte”
Frase che, più o meno, il 99% delle persone si sente dire quando acquista un cellulare, un laptop, un tablet, uno smartphone… Anche un lettore mp3 (come l’iPod).
Se a dirla fosse un non addetto ai lavori, si potrebbe anche capire; ma quando te la dice il commesso stesso dell’assistenza-rivendita… C’è qualcosa che non va.
Per una comune batteria ricaricabile agli ioni di litio, ai polimeri di litio oppure una moderna Ni-MH LSD tra i 4V ed i 6V, da 0.5A circa, e dai 1400-2000 mAh, oltre 8 di carica, con un comune caricabatterie da 1A, sono eccessive.
Veramente eccessive.
Sebbene i primi cicli di una batteria siano importanti (cicli, non ‘cariche’), e che tutte le batterie in commercio comincio a rendere al meglio dopo il 4°-5° ciclo, esagerare non solo è uno spreco di tempo, ma anche di energia.
Per riempire le celle di una 4V al litio a 1440 mAh (ad esempio), con un comune caricabatterie da 1A in input e 0.4-0.5A di output, non ci metterete più di 20-30 minuti. Alla prima carica, che poi fisicamente è uguale a tutte le altre.
Tutti i caricabatterie moderni le le litio hanno controller specifici, che regolano costantemente la tensione a seconda del numero di celle che vengono mano a mano riempite.
Questo è molto importante, perché per l’effetto Joule, mano a mano che le celle vengono riempite di elettroni, aumentano di calore. Ne consegue che se il caricabatterie non è abbastanza ‘intelligente’ da regolare la tensione a seconda delle necessità, si rischia di bruciare tutto.
Questo, nei moderni caricabatterie, come detto in precedenza, non avviene mai: perché un controller, regolato da un firmware interno, regola al meglio la carica.
Sempre parlando degli accumulatori al litio poi, la carica parte molto veloce appena si connette la batteria al caricabatterie, e si mantiene veloce, con tensione alta, almeno fino a che non s’è ricaricato il 70-80% circa delle celle; dopo tale percentuale, il controller si attiva ed abbassa piano piano la tensione, fino a riempire al 100% la batteria.
Ecco perché vi sembra che la carica sia velocissima all’inizio, e molto lenta invece alla fine. È normale: il controller sta semplicemente facendo quello per cui è stato progettato, e vi mantiene al sicuro dal rischio di esplosioni, fiammate e disgrazie varie.
Nelle batterie ancora più evolute, oltre al controller sul caricabatterie, esiste anche un controller direttamente in ognuna delle celle delle batterie stesse, che semplifica ancora di più la distribuzione adeguata della tensione, velocizzando ulteriormente la carica.
Quindi, una volta saputo questo, la domanda sorge spontanea: perché allora, c’è questa ‘leggenda metropolitana’ della carica infinita?
Semplice: perché molti anni fa, quando le pile al Ni-Cd e le prime Ni-MH (non LSD) erano praticamente le uniche alternative disponibili sul mercato degli accumulatori secondari, i caricabatterie non avevano nessun tipo di controller della tensione, e quindi per andare sul sicuro, la tensione era tenuta perennemente bassa. A prescindere dal numero di celle effettivamente caricate.
Ecco perché ci volevano circa 18 ore per caricare una batteria.
Ora tutto questo è solo un ricordo di un tempo pionieristico che fu: come detto il precedenza, quasi tutti i caricabatterie moderni, sia Ni-Cd/Ni-MH che Li-ion/Li-Poly, hanno una CPU che decide quando e come dosare la tensione, per una carica sempre ottimale ed in tempi rapidi.
Praticamente tutti i caricabatterie per le moderne Li-ion/Li-Poly, eseguono una carica completa in massimo 40 minuti.
Quindi, il luogo comune della prima carica che deve necessariamente durare come un travaglio, è decisamente… Una cosa anacronistica. Vera in passato, ma per limiti tecnici; e assolutamente non vera oggigiorno.
Piuttosto che la prima carica: è importante il primo ciclo (anzi, meglio ancora i primi 4-5 cicli) di vita della batteria.
A quelli si, dovreste fare un pelo più di attenzione.
Vedremo poi in dettaglio come si esegue un ciclo di carica ottimale per una ioni di litio/polimeri di litio.
LUOGO COMUNE NUMERO 2
“Non bisogna mai ricaricare il telefono prima che la carica della batteria sia scesa a zero”
Luogo comune PARZIALMENTE vero, ma solo per una determinata categoria di batterie: le Ni-Cd e le Ni-MH.
E questo, per il già citato ‘effetto memoria’, che affligge entrambi i tipi di batteria.
In realtà, sono ormai almeno 15 anni che tutti i cellulari, smartphone, tablet e laptop utilizzano batterie agli ioni di litio od ai polimeri di litio, quindi nel 99,9% dei casi, il luogo comune è falso.
Le batterie al litio, anzi, migliorano di rendimento e prolungano di molto il loro ciclo vitale se ricaricate spesso e volentieri, anche quando stanno al 90% di carica.
Al contrario, diventano inutilizzabili (ed a volte, anche pericolose) se ricaricate poco.
Diverso il discorso per le Ni-Cd e le Ni-MH: per la loro stessa tipologia, infatti, questo tipo di accumulatori soffrono dell’effetto memoria.
Che è molto meno presente nelle Ni-MH (soprattutto, è reversibile), ma c’è sempre.
Comunque sia, anche in questo caso, la tecnologia è migliorata e ci ha dato la soluzione, per chi non volesse attendere la fine naturale della carica: caricabatterie con scaricatore incorporato.
È una funzione presente in quasi tutti i caricabatterie per Ni-Cd/Ni-MH moderni, e la sua realizzazione è semplice: basta settare un apposito interruttore, ed il caricabatterie scaricherà velocemente la carica residua delle pile, rendendole prontissime per una nuova carica. In alcuni caricabatterie, la funzione di scarica è automatica, e l’utente deve solo inserire le batterie e accendere il caricatore: il firmware evoluto automaticamente scaricherà le cariche rimaste, e poi comincerà una nuova carica.
Anche questo luogo comune, quindi, è frutto di un’epoca passata.
LUOGO COMUNE NUMERO 3
“Se la batteria ormai è andata, mettila nel frigo: si rigenererà!”
Una delle più grosse assurdità che circolano in giro.
Il problema della leggenda metropolitana, in questo caso, è dato dalla confusione tra ‘fine ciclo di vita’ e ‘conservazione’.
Cose non proprio uguali!
I fatti stanno così: le batterie al litio, si conservano meglio entro determinate temperature.ì
Dove per ‘conservano meglio’ si intende ‘si scaricano di meno’.
Ricordiamoci che l’auto-scarica, sebbene non massiccia come nelle Ni-Cd, è presente anche nelle pile al litio.
Questa, è una cosa assodata, ma nella pratica di tutti i giorni, è ignorata da tutti.
E per un motivo: perché le batterie al litio più spesso si ricaricano, e meglio è.
Caricarle al massimo e poi metterle in frigo, quindi, oltre che stressante è anche inutile. Anzi, dannoso.
Vendete forse batterie al litio già cariche, pronte all’uso? No. E nessuno al mondo lo fa. Chiedetevi il perché.
Quando finisce il ciclo di vita di una batteria, quindi quando il processo reversibile di ossidazione dell’anodo diventa irreversibile, la batteria è da sostituire.
Non ci sono altre soluzioni: i cicli di ricarica di una qualsiasi batteria possono anche essere molti, o moltissimi (nelle moderne batterie al litio, parliamo di quasi un migliaio… Veramente tanti), ma finiscono.
E questo perché, alla lunga, i materiali che compongono le celle perdono la loro composizione chimico-fisica originaria.
In realtà, nella stragrande maggioranza dei casi, le batterie non ‘muoiono’ di colpo, ma diventano via via meno performanti, e l’utente se ne accorge sicuramente: quando con una ricarica a malapena si riesce ad usare lo smartphone od il tablet, a parità di lavoro s’intende, alla metà del tempo originario… Forse, è il caso di cominciare a pensare di sostituire la batteria.
E no, metterla nel frigo non servirà a nulla.
Al massimo, conserverà la carica che le celle ancora integre avranno.
Consigli utili
Fininiamo questo lungo articolo sulle batterie ricaricabili, con qualche consiglio utile stile: “A domanda, rispondo”.
“Hey, hai detto che non c’è bisogno di caricare per 12 ore il mio telefono, prima del primo utilizzo… Allora, di quanto debbo caricarlo per stare sul sicuro?”
Fermo restando che, ripetere giova, è il primo ciclo della batteria, semmai, ad essere molto importante, ti dirò: caricala fino a quando non raggiunge il 100%, poi tienila in carica ancora al massimo 60 minuti. Poi, usa il telefono come vuoi te: navigaci, parlaci, mandaci messaggi, vedici i video su YouTube… Quello che ti pare. Usalo. L’hai comperato per questo, o no?
Se hai speso oltre 700 Euro per un fiammante e stupendo iPhone 5S (che, tra le altre cose, ha una bellissima batteria ai polimeri di litio), perché dovresti tenerlo legato ad un filo? Vai, divertiti.
Piuttosto, ricordati di fargli fare bene i primi 4-5 cicli di carica/scarica, quello sì.
Come si fa a farglieli fare ‘bene’?
Dopo la prima carica, usa il telefono come ti pare e fin quando ti dura la batteria; noterai che, arrivati verso il 20-10% della carica, il Sistema Operativo ti avvertirà di mettere in carica il dispositivo, pena lo spegnimento imminente. Ingora l'avvertimento. Lascialo pure spegnere da solo.
Quando l’ha fatto (tanto, stai sicuro che, grazie al controller integrato sia nel telefono che nelle celle della batteria, la tensione non scenderà mai sotto un limite che potrebbe essere pericoloso), ricaricalo. Al 100%. E poi usalo come ti pare, quanto e come vuoi. Ricaricalo spesso, anzi.
Ricaricalo ogni volta che puoi. Prendi il dato empiricamente: se lo usi intensivamente, mettilo sotto carica almeno due volte al giorno, quando puoi.
Non ti preoccupare se la percentuale è al 50%, al 60%, oppure al 99%: tu caricalo.
Sono batterie agli ioni o ai polimeri di litio, adorano essere caricate spesso e volentieri. Non gli fai male, te lo assicuro.
Tutto qui: carica spesso.
“Succede un fatto strano: è da un po’ di tempo che il telefono mi si ricarica in un lampo al 100%, è molto più veloce di prima, ma… Lo stacco, lo uso, e… Puff!!! Batteria esaurita quasi subito! Perché succede ciò?”
Perché molto probabilmente la batteria del tuo amato Galaxy o iPhone sta per finire la sua esistenza terrena.
Ricorda che le batterie al litio hanno controller dappertutto, più o meno: sul caricabatterie, nel telefono, alcune anche dentro le celle stesse.
Questa ossessiva direttiva di controllare sempre il livello di carica, e di conseguenza della tensione totale della batteria, è per motivi di sicurezza: se la tensione scende oltre una certa soglia, la batteria diventa inutilizzabile. Oppure, in rari casi, esplode.
Ora, non preoccuparti: molto probabilmente, la tua batteria non esploderà. Ma morirà, questo sì.
Quasi certamente oltre il 70-80% delle celle sono ormai ossidate irreversibilmente, e la (poca) energia elettrica che ancora fornisce, la si deve ad un manipolo di eroiche celle sopravvissute che stanno vendendo carissima la pelle; il controller del caricabatterie, quindi, partirà come sempre al razzo per caricare alla massima tensione possibile quel manipolo di celle coraggiose.
Che, essendo poche sul totale, si caricheranno in un attimo.
Dopodiché, il caricabatterie fornirà una tensione bassissima, che comunque non riempirà le celle (ormai quasi tutte ossidate ed inservibili), ma si tramuterà in calore.
Ovvio che ti sembrerà un sogno: batteria carica del 100% in meno di 15 minuti!
In realtà, hai circa il 20% di carica originale che aveva la tua batteria quando l'hai caricata la prima volta, anni fa. Tutto il resto, è morto. Solo, che non lo sai.
Te ne accorgi quando cominci a consumare corrente.
Soluzione: cambia batteria.
“Come mai se navigo col Wi-Fi, oppure parlo sulla rete cellulare, la batteria mi succhia energia a manetta, ed invece in stand-by mi può durare anche una settimana?”
So che non è mai bello rispondere alle domande con altre domande (fa prendere zero nei compiti in classe, di solito), ma ti chiedo: “Come mai dopo che hai scaricato un camion intero di traforati ti senti decisamente più stanco di quando hai svitato una lampadina?”
Ti sembra banale, ma banale non è: tutto ha un costo, energicamente parlando, a questo mondo.
E produrre (o convertire) onde radio partendo dagli elettroni grazie ad un dipolo… Consuma uno sproposito di energia.
Ti basti sapere che, usualmente, un telefono a riposo consuma elettricità con una tensione che neppure arriva ad 1V; in chiamata, tale tensione sale vertiginosamente ad oltre 3V, nei moderni smartphone… Capito, sì?
E non dimenticare una cosa: i moderni smartphone sono in pratica dei super-miniaturizzati calcolatori, in cui il baseband e la parte telefonica sono un qualcosa ‘in più’.
Non sono certo la parte essenziale del dispositivo. Fa strano dirlo, visto che si parla comunque di telefoni, ma… Così è.
Quindi, se prendi un qualsiasi smartphone moderno e gli estrai la scheda logica, rimarrai sorpreso: ci sono saldati sopra interi SoC (System on a Chip: praticamente, CPU, GPU e MMU inclusi in un solo circuito integrato), moduli Wi-Fi, Bluetooth, GSM, controller USB e controller schede SD, memorie flash… Insomma, un vero e proprio calcolatore, peraltro molto potente, in miniatura!
Già il vortice elettronico è impressionante in un calcolatore desktop tradizionale (te le accorgi dalle ventole del case che girano), immagina lo stesso vortice in quello stampato pieno zeppo di integrati, eppure così piccolo…Pazzesco!
Tutto ciò, consuma corrente. Molta corrente. Che da la batteria, ovviamente.
E più la CPU lavora, più corrente consuma, necessariamente; non c’è un modo per aggirare questa cosa. Al massimo, con un Sistema
Operativo messo a puntino, si può limitare il consumo di corrente, principalmente istruendo la CPU ad ottimizzare i processi, ma… I miracoli, non si possono fare.
Considera poi un’altra cosa: il tuo bel display Retina è fantastico, ma è illuminato. Tante piccole lucine si accendono magicamente dietro il tuo LCD, ogni volta che smanetti sul telefono. Consumano energia.
Quindi, ti ridomando: come ti senti dopo che hai scaricato un camion di mattoni forati? E come ti senti, a paragone, dopo che hai svitato una lampadina?
Ti senti stanco allo stesso modo? Non credo, a meno che tu non abbia muscoli e tendini in titanio, e adori mangiarti plutonio a colazione.
“Mi è morto il tablet. Sul serio: non si accende più! E neppure si ricarica! E pensare che, fino ad oggi, per quattro anni non mi ha dato mai nessun problema!”
Sai, anche io, una volta, ho avuto una carie che mi è arrivata al nervo.
Eppure, per tanti anni, quel dente non mi aveva mai dato nessun problema.
Poi, una sera, ho urlato dal dolore…
Quando una batteria muore, a volte muore e basta, e sei fortunato.
Altre volte, se sei sfigato, si porta appresso qualcosa di tuo.
È molto probabile che il connettore del tuo tablet sia bruciato: se il controller interno alla batteria non ha fatto il suo lavoro, il caricabatterie magari ha dato troppa tensione al tutto, bruciando il connettore. È un’ipotesi che capita spesso, e sempre in presenza di batterie esaurite.
“Guarda caso, la batteria del mio smartphone è morta proprio dopo i due anni di garanzia… Obsolescenza programmata, eh??”
No. Io direi semplicemente: congedo con onore.
Se hai utilizzato, come si presume, il tuo smartphone ogni giorno, almeno almeno 14 ore al giorno per due anni, la tua batteria ti ha servito egregiamente per circa 10.000 ore.
Ipotizzando un ciclo completo ogni, diciamo, 20 ore (mi tengo un po’ altino), la tua batteria è durata più di 500 cicli completi.
Sono una quantità ragguardevole.
Tieni presente che il produttore, giustamente, ti garantisce un numero sufficiente di cicli di ricarica per la durata stessa della garanzia. Mi pare ovvio, no?
La batteria ha cicli elevati, ma limitati: nessun produttore potrebbe mai, anche in una botta di bontà esagerata, garantirti una durata infinita, per nessun tipo di batteria ad oggi in commercio.
“Ho una batteria integrata che debbo sostituire. Il telefono è fuori garanzia, e il centro autorizzato della mia marca, mi ha chiesto uno sproposito. Soluzioni?”
Rivolgiti ad un professionista esterno.
Sicuramente i centri di assistenza autorizzati sono molto professionali, ed i tecnici competenti, ma hanno prezzi molto elevati. Per tanti fattori, tra cui i costi che impone la casa madre giocano un ruolo fondamentale.
Spesso, le cifre sono alte a prescindere dal pezzo/lavoro eseguito.
Tuttavia, fortunatamente, in giro per l’Italia si possono trovare tantissimi professionisti non di certo meno preparati di quelli ‘ufficiali’ dei centri assistenza (anzi, a volte con le stesse identiche certificazioni) che, liberi dai costi imposti dalla casa produttrice, possono farti prezzi decisamente migliori.
Attenzione: ‘migliori’ non vuol dire ‘stracciati’.
I professionisti seri non fanno dumping: si fanno concorrenza, ma oltre un certo limite, il guadagno semplicemente non esiste.
Comunque, un bel risparmio del 20 o del 30%, rispetto al prezzo di listino di un centro autorizzato, vale comunque la candela.
Ed il servizio, da parte dei veri professionisti, non è inferiore a quello che puoi trovare nei centri autorizzati.
Ricorda che, se il telefono non è più in garanzia o se hai rotto parti che la garanzia non copre (uno su tutti: il display), non devi necessariamente rivolgerti ad un centro autorizzato, ma puoi andare da chi pensi lavori meglio, o che ti fa il prezzo da te giudicato migliore.
I costruttori vorrebbero che tutti andassero a farsi riparare le cose nei loro punti ufficiali, ed i motivi di ciò sono lampanti; ma fortunatamente, esiste ancora la proprietà privata, al mondo… Ed il diritto di disporre come si vuole di ciò che è stato regolarmente acquistato.
Prenota il cambio batteria iPhone

Devi cambiare la batteria del tuo iPhone?
Lo facciamo noi a partire da soli € 49,00!
Prenota da noi il cambio batteria del tuo iPhone: è facile e veloce
Possiamo cambiare la batteria del tuo iPhone di qualsiasi modello in pochissimo tempo: qualità garantita a partire da soli € 49,00!
Chiamaci con fiducia, copriamo tutta l'area del Comune di Milano, anche con servizio espresso in soli 30 minuti dalla chiamata, direttamente dove sei te!
Offriamo solamente servizio in loco in tutta Milano, non abbiamo una sede fisica: ciò ci permette di risparmiare sui costi e garantire prezzi e tempi d'intervento eccezionali!
Compila il modulo qui in basso per prenotare velocemente il cambio batteria del tuo iPhone:
Abbiamo i prezzi più bassi del mercato, ma non rinunciamo mai alla qualità.
 ATTENZIONE!
ATTENZIONE! 
TUTTE LE BATTERIE, SIA PRIMARE CHE RICARICABILI, CONTENGONO METALLI, LEGHE E SOSTANZE ALTAMENTE TOSSICHE. MANEGGIARE SENZA LE OPPORTUNE PRECAUZIONI LE BATTERIE ESAURITE, E SOPRATTUTTO SMALTIRLE IN MANIERA IMPROPRIA, PUÒ CAUSARE GRAVI RISCHI PER LA SICUREZZA, SIA DEL SINGOLO CHE DELLA COLLETTIVITÀ.
IN ITALIA, PER LEGGE (D.Lgs. 188, datato 20 Novembre 2008) È OBBLIGATORIO SMALTIRE PILE PRIMARIE ED ACCUMULATORI RICARICABILI SECONDO LE DISPOSIZIONI DEL LEGISLATORE.
NOI SMALTIAMO, SENZA COSTI AGGIUNTIVI PER IL CLIENTE, LE BATTERIE ESAUSTE CHE CAMBIAMO, DIFFERENZIANDOLE E PORTANDOLE NEI CENTRI AUTORIZZATI DI RACCOLTA PILE ESAUSTE GESTITI DALL'AMSA NEL TERRITORIO DI MILANO.
QUESTO MESSAGGIO È QUINDI DI ESTREMA IMPORTANZA: I METALLI PESANTI, ED I COMPONENTI TOSSICI PRESENTI NELLE BATTERIE, SONO UN SERIO PERICOLO PER LA TUA SALUTE, E PER QUELLA DI TUTTA LA SOCIETÀ.
Lasciamo volentieri agli altri batterie di scarsa affidabilità.
In aggiunta, ad ogni cambio di batteria il vostro iPhone viene accuratamente controllato, pulito da eventuali polveri e/o altre impurità e consegnato solo dopo un preciso esame (in cui viene eseguito uno stress test di iOS, viene verificato il funzionamento delle fotocamere, della ricezione GSM, dell'antenna Bluetooth, Wi-Fi... E tante altre cose) ed una prima carica della batteria completa al 100%. Affinché possiate usare il telefono in tutta sicurezza, certi che la vostra nuova batteria vi accompagnerà per tanti cicli di carica.
